Emite Cofepris alerta sanitaria por comercialización ilegal del producto Prolia
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) ratificó la alerta sanitaria dirigida a las y los profesionales de la salud y a la población sobre la comercialización irregular del producto prolia® 60mg/mL (Denosumab) en presentación jeringa prellenada.
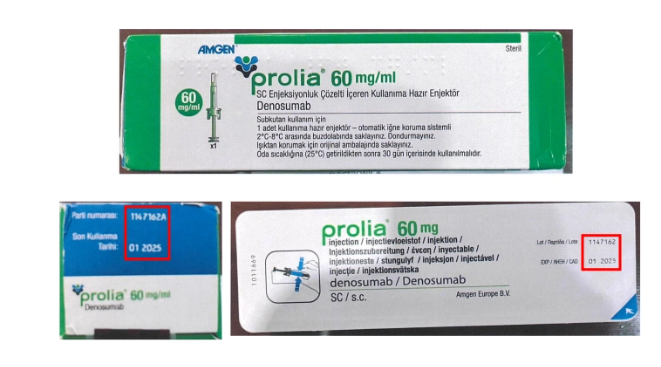
A principios de enero pasado emitió la primera advertencia sobre ese medicamento, luego de que la empresa Amgen México, S.A. de C.V., titular del registro sanitario, informó que identificaron la distribución del producto con número de lote en estuche 1147162A, lote en jeringa 1147162 y caducidad en enero de 2025; el cual fue destinado exclusivamente para su comercialización en Turquía.
Dado que dicho producto se elaboró para ser comercializado en otro país, cuenta con textos y leyendas en idiomas diferente al español y carece de registro sanitario
“El medicamento prolia® con las características antes citadas no fue importado por la empresa y no cuenta con registro sanitario otorgado para México, por lo que no se garantiza la seguridad, calidad y eficacia del mismo, al desconocer las condiciones de trasporte, almacenamiento y distribución, por lo que representa un riesgo para la salud de las personas”.
Denosumab es un fármaco para el tratamiento de la osteoporosis en mujeres posmenopáusicas y para hombres con alto riesgo de fractura.
La Jornada